
2022年12月26日,河北科技师范学院杨越冬教授团队联合深圳大学肖海涛博士在国际期刊Marine Drugs(Q1,IF: 6.085)发表题为“ Fuc-S—A New Ultrasonic Degraded Sulfated α-l-fucooligosaccharide—Alleviates DSS-inflicted Colitis through Reshaping Gut Microbiota and Modulating Host–Microbe Tryptophan Metabolism”的研究性论文。肖海涛博士和冯金秀为论文共同第一作者,杨越冬教授和杜彬教授为通讯作者。该研究受国家自然科学基金(8156067)和河北省中央引导地方科技发展资金项目(216Z3201G)资助。
炎症性肠病(IBD)是一种慢性炎症性疾病,存在两种亚型溃疡性结肠炎(UC)和克罗恩病(CD)的肠粘膜-其特征在于紧密调节的肠道免疫系统失调。传统上,IBD多见于北美和欧洲。目前,IBD代表随着工业化国家发病率的增加,严重影响患者的生活质量医疗保健系统的负担。迄今为止,IBD的确切发病机制尚不清楚,受遗传易感性、免疫反应、肠道微生物区系和环境因素影响;因此,目前没有很好的治疗方法。研究范围:肠道微生态失调在肠道疾病中起着重要的致病作用炎症性肠病的发展。方法和结果:一种名为Fuc‐S、 分子量为156kDa。单糖组成、FTIR、甲基化和NMR光谱分析表明,Fuc‐S可以具有由以下组成的主干→3) ‐α‐L‐Fucp‐(1→, →4) ‐α‐L‐Fucp‐(1→ 和→3,4)‐α‐D‐Glcp‐(1→. 此外,雄性C57BL/6小鼠被喂食三个周期的1.8%葡聚糖硫酸钠(DSS)5天,然后用水7天以诱导结肠炎。纵向微生物组变化通过16S扩增子测序进行评估。体内试验表明,Fuc‐S显著改善临床表现、结肠缩短、结肠损伤和结肠炎性细胞浸润与DSS诱导的小鼠慢性结肠炎相关。进一步研究表明感染与结肠中Akt、p‐38、ERK和JNK磷酸化的抑制有关组织,调节肠道微生物群的结构和丰度,并调节宿主——慢性结肠炎小鼠的微生物色氨酸代谢。结论:我们的数据得到证实岩藻多糖主链中葡萄糖的存在,并提供了Fuc‐S可以作为IBD治疗的有效功能性食品和药物候选。
研究亮点
制备了一种新型超声降解Fuc-S,并对其结构进行了表征。
Fuc-S显著减轻了DSS诱导的小鼠慢性结肠炎的严重程度。
Fuc-S重塑了DSS诱导的结肠炎中失衡肠道微生物群的结构。
Fuc-S在DSS诱导的慢性病中调节宿主微生物色氨酸代谢。
成果介绍
在本研究中,一种新的均匀超声降解多糖分子量为156 kDa的Fuc‐S是由岩藻多糖制备。这种多糖的骨架由→3) ‐α‐L‐Fucp‐(1→, →4)‐α‐L‐Fucp‐(1→ 和→3,4)‐α‐D‐Glcp‐(1→, 在其他岩藻聚糖中很少观察到。对于构象信息分析,发现Fuc‐S在0.9%NaCl溶液中具有随机螺旋构象。实验和体内试验证实Fuc‐S可有效缓解DSS诱导的小鼠慢性结肠炎。这种有利影响与抑制炎症细胞浸润和促炎细胞因子的产生PI3K/AKT和MAPK激活,以及抑制宿主-微生物色氨酸代谢并调节肠道微生物群。可以得出结论,Fuc‐S是一个有前途的治疗IBD的营养候选药物。
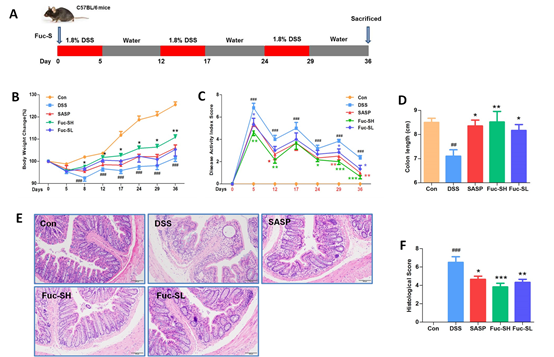
图1 Fuc‐S改善了DSS诱导的小鼠慢性结肠炎的临床表现和结肠损伤
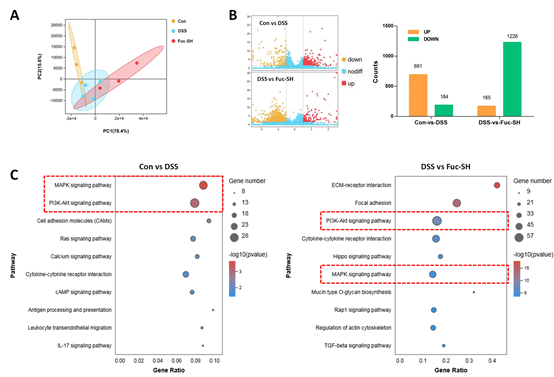
图2 Fuc‐S治疗DSS诱导的小鼠慢性结肠炎的结肠转录组学分析
原文链接:Haitao Xiao, Jinxiu Feng, Jiao Peng, Peigen Wu, Yaoyao Chang, Xianqian Li, Jinhui Wu, Haifeng Huang, Huan Deng, Miao Qiu, Yuedong Yang *, Bin Du *. Fuc-S, a new ultrasonic degraded sulfated α-L-fucooligosaccharide, alleviates DSS-inflicted colitis through reshaping gut microbiota and modulated host-microbe tryptophan metabolism. Marine Drugs, 2023, 21(1), 16; https://doi.org/10.33